PEMBENTUKAN DAN SIFAT-SIFAT ASAM KARBOKSILAT
Hi… chems ketemu lagi nih kali ini kita akan membahas
tentang asam karboksilat, apa itu asam karboksilat? Asam karboksilat itu
merupakan salah satu jenis senyawa organic yang sangat identik dengan gugus karboksil
(-COOH) yang dimana merupakan gabungan dari gugus karbonil (-CO) dan gugus
hidroksil (-OH) yang kemudian disingkat jadi karboksil. Perlu diketahui pula
bahwa asam karboksilat ini juga masuk ke dalam kelompok senyawa polar kemudian
dapat membentuk ikatan antar molekulnya.
Yok
kita langsung masuk kepada pembentukan asam karboksilat, pembentukannya sebagai
berikut ini :
1.
Oksidasi
Alkohol Primer
Oksidasi alkohol primer ini dilakukan dengan bantuan
katalis kalium permanganate yang dimana akan menghasilkan asam karboksilat.
Contoh :
Ketika alkohol primer diubah menjadi asam karboksilat,
atom karbon terminal meningkatkan keadaan oksidasi empat. Oksidan yang mampu
melakukan hal tersebut biasanya yang digunakan adalah KMnO4, reagen
jones, RuO4. Dalam kondisi yang terkendali, KMnO4 akan
ditambahkan ke larutan atau suspensi alkohol dalam larutan air berair basa.
Biasanya oksidasi ini dilakukan dalam keadaan basa yang kuat,reaksi dapat
dilakukan pada pH yang lebih rendah atau bahkan dalam kondisi asam.
2.
Karbonasi
pereaksi Grignard
Reaksi pereaksi Grignard dengan karbon dioksida, pereaksi
Grignard ini akan bereaksi dengan karbon dioksida dalam dua tahapan. Pada
tahapan pertama, pereaksi Grignard diadisi ke karbon dioksida. Karbon doksida
kering digelembungkan melalui sebuah larutan pereaksi Grignard dalam
etoksietana, yang dibuat seperti dijelaskan di atas.
Contoh :
Produk yang akan terbentuk itu akan dihidrolisis
(direaksikan dengan air) dengan bantuan asam encer. Biasanya, anda bisa
menambahkan asam sulfat encer atau asam hidroklorat encer ke dalam larutan yang
dihasilkan oleh reaksi dengan CO2. Jika ditambahkan satu atom karbon lagi, maka
akan terbentuk asam karboksilat bukan pereaksi Grignard
3.
Oksidasi
alkil benzene
Oksidasi alkil benzene dengan katalis kalium bikromat
dan asam sulfat maka akan menghasilkan asam karboksilat.
Contoh:
Seberapapun panjangnya gugus alkil maka akan tetap
didegradasi menjadi gugus karboksilat benzoat
4.
Hidrolisis
senyawa nitril
Hidrolisis senyawa nitril dalam suasana asam maka akan
membentuk asam karboksilat
Contoh :
Mekanismenya adalah senyawa nitril tersebut akan
dipanaskan dengan refluks dengan asam encer seperti asam hidroklorat encer maka
asam karboksilat akan terbentuk.
Misalnya, mulai dari ethanenitrile Anda akan mendapatkan asam etanoat. Asam
etanoat dapat disuling dari campuran.
SIFAT-SIFAT ASAM KARBOKSILAT
Sifat Fisikanya
·
Wujud
Diketahui bahwa pada temperatur ruangan, asam karboksilat
yang bersuku rendah (C1 –C4) berwujud cair yang encer, yang bersuku tengah (C5-
C9) berwujud zat cair yang kental, sedangkan asam karboksilat bersuku tinggi (C
> 10) berwujud padat yang tidak dapat larut begitu saja dalam air.
·
Titik
Didih dan Titik leleh
Adanya ikatan hidrogen anatar molekulnya menjadikan
titik didih dan titik leleh asam karboksilat relatif tinggi. Ada gaya tarik menarik
yang kuat antar molekulnya. Semakin panjang rantai C nya maka semakin tinggi
titik didih dan titik leburnya.
·
Kelarutan
Hanya asam karaboksilat suku rendah yang dapat
dilarutkan sempurna dalam air, sedangkan suku tengah dan suku tinggi sifatnya
sukar larut dalam air.
·
Daya
hantar listrik
Karena adanya proses ionisasi yang terjadi ketika
dilarutkan meupakan ionisasi sebagian maka asam karboksilat ketika dilarutkan
dalam air maka akan menghasilkan larutan elektrolit lemah.
Sifat-sifat Kimianya
·
Ikatan
kimia
Asam karboksilat mengandung ikatan yang disebut ikatan
hidrogen. Ikatan ini menghubungkan antar molekul senyawa asam.
·
Kepolaran
Karena memiliki gugus hidroksil yang memiliki sifat
polar maka asam karboksilat termasuk kedalam kelompok senyawa polar.
·
Kereaktifan
Tingkat kereaktifan asam karboksilat ini semakin
menurun seiring dengan peningkatan jumlah atom karbon. semakin tinggi sukunya
maka akan semakin tidak reaktif.
·
Reaksi
dengan basa
Jika asam karboksilat direaksikan dengan basa maka
akan menghasilkan garam dan air.
Contoh :
·
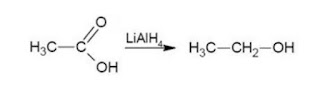
Reduksi
Reduksi yang terjadi pada asam karboksilat dengan
katalis litium alumunium hidrida maka akan menghasilkan alkohol primer.
Contoh :
·
Reaksi
dengan tionil diklorida
Asam karboksilat jika direaksikan dengan tionil diklorida
menghasilkan klorida asam, hidrogen klorida dan gas belerang dioksida.
Contoh :
PERMASALAHAN
1.
Diketahui
pada oksidasi alkohol primer menjadi asam karboksilat dilakukan dalam keadaan
yang basa tetapi bisa juga dalam kondisi asam, mengapa hal tersebut dapat
terjadi?
2.
Dinyatakan
pada blog saya pada bagian pembentuksn asam karboksilat bahwa seberapapun
panjangnya gugus alkil maka akan tetap didegradasi menjadi gugus karboksilat benzoat
mengapa hal tersebut dapat terjadi?
3.
Pada
blog saya mengenai sifat fisika dari asam karboksilat disebutkan bahwa asam
karboksilat ketika dilarutkan dalam air maka akan menghasilkan larutan
elektrolit lemah, mengapa hal semacam itu dapat terjadi? Dan peristiwa apakah
yang akan terjadi bila asam karboksilat itu dilarutkan dalam larutan basa?









Kami jwab no 3
BalasHapusSaya Risa Novalina (070) akan menjawab permasalahan no 1
BalasHapusMengapa bisa dalam keadaan basa maupun asam karena pada saat direaksikan dengan basa alkohol primer bersifat asam lemah dan lebih lemah daripada air, biasanya oksidasi alkohol primer dilakukan dalam kondisi basa kuat karena mendorong kecepatan dan selektivitas oksidasi yang lebih besar, reaksi oksidasi ini bisa juga berlangsung dalam kondisi asam tapi kecepatan reaksinya sangat menurun.
Semoga membantu
Perkenalkan nama saya Jony Erwin (098) akan menjawab permasalahan no 2
BalasHapusKarena sifat asam karboksilat adalah yaitu merupakan asam lemah dimana semakin panjang rantai c nya maka semakin semakin lemah lah asamnya. Jadi asam makin lemah pun akan tetap bisa jadi gugus karboksilat benzoat
3. WISLIANA (A1C118060)
BalasHapusasam karboksilat ketika dilarutkan dalam air maka akan menghasilkan larutan elektrolit lemah hal itu dikarenakan Asam karboksilat termasuk kedalam kelompok senyawa polar dan ia membentuk ikatan hidrogen antar molekulnya. Jika asam ini dilarutkan dalam air akan menghasilkan asam lemah yang sebagian terionisasi menjadi ion H+ dan RCOO–.
Karena proses ionisasi yang terjadi ketika dilarutkan meupakan ionisasi sebagian maka asam karboksilat ketika dilarutkan dalam air akan menghasilkan larutan elektrolit lemah.
Asam karboksilat dilarutkan dalam larutan basa (Reaksi dengan Basa) disebut peristiwa (rekasi penyabunan/saponifikasi)
ketika senyawa asam karboksilat bereaksi dengan basa akan menghasilkan garam dan air. menurut rumus:
R-COOH + NaOH → R-COONa (sabun) + H2O